第9章 火成岩(1)
マグマはマントル上部で発生する。マントル上部はかんらん岩であるが、そのかんらん岩が部分溶融して玄武岩質マグマになる。これについては、こちらを参照。なお、マグマにはマントルを作っているかんらん岩が部分溶融してできるマグマだけではなく、玄武岩質マグマが上昇する過程で地殻下部の岩石も融かして、それらが混じってできるマグマもあると考えられる。
かんらん岩はかんらん石70%、輝石30%程度からなる岩石である。かんらん石と輝石は違う鉱物であり、それらの間では固溶体をつくらない。こうした固溶体を作らないものを融かすとき、また冷え固まるときは不連続的に組成が変わることがある。詳しくは固溶体を作らない場合の相平衡図(1)、固溶体を作らない場合の相平衡図(2)を参照。
こうして、マグマが発生する深さ(圧力)によっておなじ玄武岩質マグマといっても、その組成が微妙に違うものができることもある。玄武岩質マグマは冷え固まるときにいろいろな鉱物の組み合わせを持った様々な種類の火成岩ができることになる。これについては、かんらん岩の部分溶融を参照。
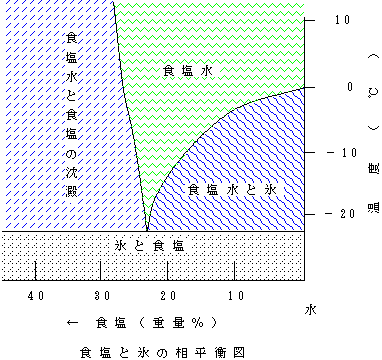
固溶体を作らない場合の相平衡図(1):水(H2O)と食塩(塩化ナトリウム、NaCl)は固溶体と作らない。その相平衡図を下に示す。純粋な水であれば、液体である水と固体である氷が同時に存在できるのは0℃のときだけで、0℃よりも温度が高ければ水(液体)、0℃よりも温度が低ければ氷(固体)となる。つまり決まった融点(凝固点)があり、水(H2O)の場合は1気圧では0℃である。純粋な水では0℃で氷になり始め、すべてが氷になる間は冷やし続けても温度は下がらない。冷やし続けた場合、すべてが氷になると再び温度が下がり始める。0℃よりも温度が低い氷に熱を加えると、0℃で融けて水ができ始める。その間熱を加え続けても温度は上がらず、その熱は氷を水に変えるために使われる。すべてが水になると再び温度が上がり始める。
純粋な水に食塩を溶かしていくと、食塩が少ないうちはすべての食塩が水に溶けて食塩水となる。ところが水に溶け込むことができる食塩の量には限界がある。限界量以上の食塩を溶かそうとしても水には溶けずに、溶け残った食塩は固体のままである。これが下図の左側の「食塩水と食塩の沈殿」の部分である。
食塩がすべて水に溶けた食塩水の温度を下げていく。食塩水は0℃になっても氷はできない。0℃よりも温度が下がっても食塩水のままである。さらに温度を下げると、食塩水の濃度に応じた温度で氷ができ始める。このときにできる氷は純粋な氷であり、食塩水氷というものはない。食塩水から氷ができ始めると、食塩水から氷として水が抜けていくので、残った食塩水の濃度は高くなる。つまり、薄い食塩水の温度を下げていくと、固体としては氷、残った液体は食塩水ということになる。これが下の「食塩水と氷」の部分である。
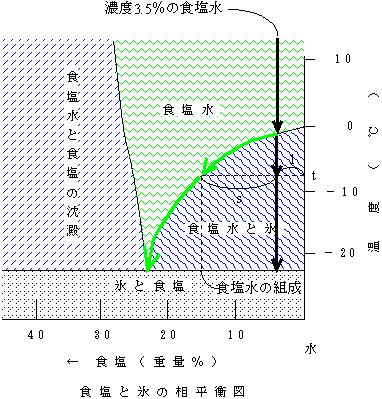
例えば海水程度の濃度である3.5%の食塩水の温度を下げていくと、約−1.8℃で凍り始める。しかしそのときにできる氷は純粋な氷である。さらに温度を下げてもできてくるのは純粋な氷であり、残った食塩水の濃度はだんだんと濃くなっていく(密度も高くなる。海水が結氷を始めるとまわりの海水の密度は高くなる。)。下の図でt℃まで温度を下げたときは純粋な氷(固体)と、はじめよりかなり濃度が高くなった食塩水(液体)が、s:lの割合で混じったものとなっている。こうして温度を下げていくと、だんだんと固体である氷の割合が多くなり、それにつれて残った食塩水の濃度が緑の線に沿って高くなっていく。イメージとしては、固溶体を作る場合の相平衡図における液相線が「食塩水」と「食塩水と氷」の境界線、右の縦軸が固相線という感じである。
ここで、−21.4℃まで温度が下がると突然に食塩も析出して、全体に氷と食塩が混ざったものができる(やっとすべてが固体になる)。もちろん、全体の組成は元のように氷:食塩=3.5:96.5である。しかし実際には、晶出した氷は残った食塩水に浮くので、上の方に氷が、下には氷と食塩が混じったものになっている。
逆に非常に温度の低い状態で氷:食塩=3.5:96.5を混ぜたものの温度を上げていくと、−21.4℃で濃い食塩水ができ始める。つまり、最初の固体(の混合物)の組成とは全く異なった液体ができてくる。このとき熱を加え続けても、食塩水(液体)が一定量できるまでは温度は上がらず、その熱は氷を溶かすために使われる。さらに熱を加えて温度を上げていくのに従い氷の割合が小さくなって(食塩水の割合が大きくなって)、最終的は−1.8℃で3.5%の濃度の食塩水となる。
つまり、食塩(固体)と氷(固体)と食塩水(液体)の3つが共存できるのは、−21.4℃の場合のみである。氷に対し食塩を22.4%の割合で混ぜると、自然にこの−21.4℃という低温が得られる。このポイント(食塩22.4%、温度-21.4℃)を共融点(共晶点)という。
氷と食塩のように低温が得られる混合物を寒剤という。冬の道路にまかれる凍結防止剤もこのような寒剤を利用している。寒剤を利用すると、全部が固体になるために非常な低温にならないとならなくなるので、道路の凍結が防止されるというわけである。
寒剤としては、食塩(塩化ナトリウム)と氷のほか、エタノールとドライアイスで−72℃というものもある。
 |
 |
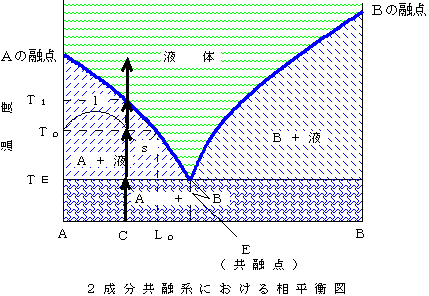
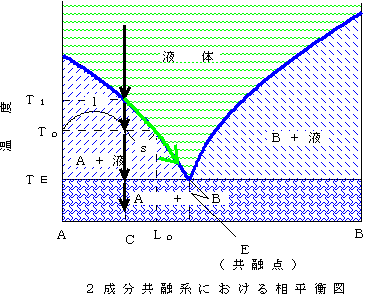
固溶体を作らない場合の相平衡図(2):いま固溶体を作らないAとBの混合物を考える。温度が低ければ、固体Aと固体Bが混ざったもの、温度が高ければ液体Aと液体Bが混ざったものという状態になっている。そしてある温度範囲で、固体A(純粋な固体A)とAとBが混ざった組成の液体(図の「A+液」の部分)、また固体B(純粋な固体B)とAとBが混ざった組成の液体(図の「B+液」の部分)のように固体と液体が共存できる。なお、純粋なA、純粋なBにはもちろん決まった融点がある。Eが共融点であり、ここでのみ固体A、固体B、AとBが混ざった組成の液体の3つが共存できる。
下の左図で、組成C(A85%、B15%)の固体の温度を上げていくと、共融点の温度TEで液体ができ始める。そのときにできる液体の組成はEであり、はじめの固体の組成よりもはるかにBに富んだものになっている。もしこの液体が分離すれば、最初の組成CよりもBに富んだ液体が得られることになる。
このままずっと温度を上げて、温度がTlになるとすべてが液体になり、そのときは最初とおなじ組成CA85%、B15%で混ざった)液体になっている。
途中のToという温度では、固体は純粋なAであるが、液体の組成は融け始めたときよりも少しCに近づいている。またそのときの固体:液体の割合は図のs:lである。
今度は(下右図)。温度TlでAの結晶ができ始める。晶出した結晶Aと残液を反応させながら温度を下げて行くと、途中の温度Toでは結晶Aと残液(緑の線に沿ってBの割合が増えてこの温度では組成Lo)がs:lの割合で、結晶(固体)Aと液体がが混じった状態になっているが、TEまで温度を下げると突然に結晶Bも晶出して、最終的には最初の液体とおなじ組成(A85%、B15%)で結晶Aと結晶Bが混ざった状態の固体になる。
ところが、C(A85%、B15%)という組成を持った液体を冷やしていくときに、晶出した結晶Aが分離(固体である結晶は残液よりも密度が高いので沈殿すると考える)すると、下の方にはAの結晶だけが沈殿する。そして温度がTEまで下がると、突然に結晶Bも晶出してくる。つまり、右の図のように、沈殿物を見ると下の方は結晶Aだけ、それがあるところから急に結晶Bも混ざるようになる。
このように、マグマが冷えて岩石を作るとき、不連続的に鉱物の組み合わせが変わることが起きうる。
 |
 |
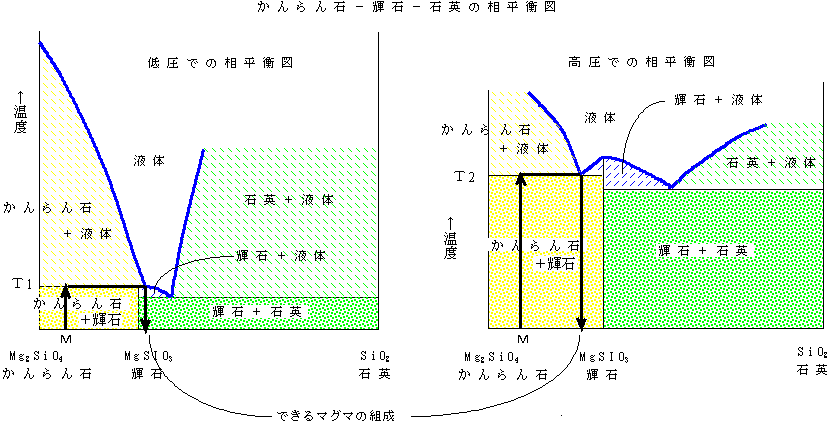
かんらん岩の部分溶融:かんらん石(Mg2SiO4)−輝石(MgSiO3)と輝石−石英(SiO2)の相平衡図をまとめた、かんらん石(Mg2SiO4)−輝石(MgSiO3)−石英(SiO2)の相平衡図を下に示す。下左図は圧力が低い場合(浅い場合)、下右図は圧力が高い場合(深い場合)である。圧力が高いほど融け始める温度も高くなっている。しかし、液体と固体(かんらん石、輝石、石英)が共存できる範囲が微妙に異なることに注意。なお実際には、石英が融けるほどの温度では石英は別な形(多形)になっている。
マグマが発生するマントル上部の岩石は、かんらん石70%、輝石30%程度からなるかんらん岩である。下の図ではMという組成になる。
圧力が低いところでかんらん岩を融かすと、T1という温度でかんらん岩が融け始めてマグマができてくる。そのマグマの組成は輝石(MgSiO3)よりも右側の石英(SiO2)よりになる。圧力が高いところでは、T2というより高い温度にならないとマグマはできてこない。そしてそのときのマグマの組成は輝石より(MgSiO3)も左側、すなわち圧力が低いところでできるマグマよりSiO2の少ない組成になっている。
いずれにしても最初にできるマグマは、最初のかんらん岩(組成M)よりははるかにSiO2に富んだ(図ではMよりも右側)玄武岩の組成になっている。しかし、かんらん岩の部分溶融が起こる深さ、すなわちマグマが発生する深さ(圧力)によってその組成が微妙に異なり、圧力の低いところで(浅いところで)発生するマグマは比較的SiO2に富んだ、圧力の高いところで(深いところで)発生するマグマは比較的SiO2に乏しいマグマが発生することがわかる。このことについては、日本の火山の分布やマグマの発生(1)も参照。